1.Bioassay nedir?
Basit tanımıyla bioassay, bir maddenin (örneğin insektisit, ilaç, toksin, bitki özü vb.) etkisini veya “gücünü” canlı organizmalar, dokular, hücreler ya da mikroorganizmalar üzerindeki biyolojik yanıtına bakarak nicel olarak belirlemeye yarayan yöntemler grubudur (Rosso, 2010; Saha, 2002; Wikipedia, 2025).
Uyarı/yanıt (dose/response)
Bioassay’de uygulanan uyarı (doz / konsantrasyon) ve ölçülen yanıt (ölüm, gelişme geriliği, doğurganlık azalması, beslenmenin durması, vb.) temel bileşenlerdir (Finney, 1947; Finney, 1971).
Yanıt sınıflaması:
- ikili (ölü/sağ, var/yok) ise “quantal” bioassay
- sürekli (örneğin ağırlık artışı, enzim aktivitesi) ise “quantitative” bioassay
(Finney, 1971; Saha, 2002).
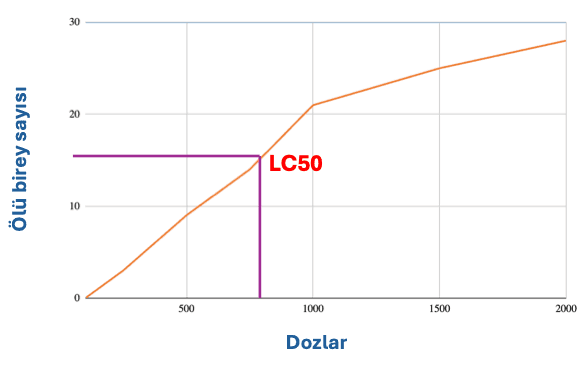
İlaç, pestisit ve çevre toksikolojisinde, farklı dozlara karşı oluşan yanıtın analizi ile LC₅₀, LD₅₀ gibi toksisite değerleri; sabit bir dozun belli bir süredeki maruziyet etkisini ifade etmek için ise LT₅₀ gibi zamana bağlı toksisite değerleri hesaplanır. Bu analizler çoğunlukla probit/lojit analiz gibi istatistiksel yöntemlerle yapılır (Finney, 1971; National Research Council, 1988).